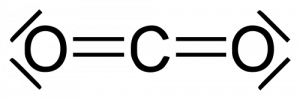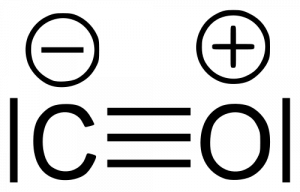Ich kann nicht kochen. Das ist bekannt. Aber selbst ich habe noch nie Wasser anbrennen lassen. Warum ist das so? (An manchen Stellen erkläre ich etwas Chemie in kursiv und Amateurbegriffen. Das kann ignoriert werden, wenn man sich nicht für Näheres interessiert.)
Wenn Dinge anbrennen, dann bedeutet das, sie oxidieren in einer exothermen (also Wärme-abgebenden) Reaktion. Schauen wir uns das an:
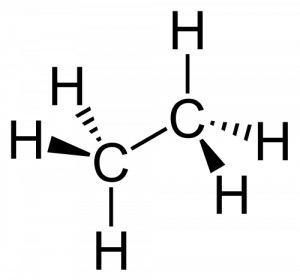 Praktisch alle organischen Stoffe auf unserem Planeten sind Kohlenwasserstoff-Verbindungen. Prinzipiell kann man sagen, es handelt sich hierbei um aneinanderhängende Kohlenstoff-Atome, an deren Rändern sich Wasserstoff-Atome befinden. Als Beispiel haben wir hier am Rand das „Ethan“, einen der einfachsten Kohlenwasserstoffe. Zwei aneinanderhängende Kohlenstoff-Atome (C) und drumherum sechs Wassestoff-Atome (H).
Praktisch alle organischen Stoffe auf unserem Planeten sind Kohlenwasserstoff-Verbindungen. Prinzipiell kann man sagen, es handelt sich hierbei um aneinanderhängende Kohlenstoff-Atome, an deren Rändern sich Wasserstoff-Atome befinden. Als Beispiel haben wir hier am Rand das „Ethan“, einen der einfachsten Kohlenwasserstoffe. Zwei aneinanderhängende Kohlenstoff-Atome (C) und drumherum sechs Wassestoff-Atome (H).
Um jedes Atom kreist eine Menge von Elektronen. Diese Menge von Elektronen entspricht genau der Ordnungszahl des jeweiligen Stoffes im Periodensystem (Wasserstoff = 1 und Kohlenstoff = 6). Die Elektronen Kreisen dabei jeweils in Gruppen (sog. Schalen) um den Atomkern. In die erste Schale passen 2 Elektronen und in die äußerste immer 8 (alle weiteren Regeln können wir hier ignorieren). Atome streben dazu, ihre äußere Schale entweder zu „füllen“ oder zu „leeren“. Daher verbinden sie sich mit anderen Atomen, indem sie ihre Elektronen abgeben, um diesen stabilen Zustand zu erreichen.
Wasserstoff hat in der äußeren Schale 1 Elektron. Kohlenstoff hat 4 Elektronen in der äußeren Schale (sog. „freie Valenzen“). Darum verbindet sich der Kohlenstoff mit einem anderen (so sind jeweils ein Elektron gebunden) und an die drei „freien Plätze“ rücken die einzelnen Elektronen des Wasserstoffes und voila, eine stabile Verbindung.
Das Ethan, was wir hier sehen, ist in gewissem Maße in Erdgas/Heizgas enthalten. Aber gehen wir wieder zum verbrennen. Wir wissen, dass es für Feuer Sauerstoff (Chemisches Symbol O) braucht. Ähnlich wie der menschliche Körper „atmet“ Feuer.
Auch im Körper werden Kohlenwasserstoffe zur Energiegewinnung oxidiert. Daher auch der Begriff des „Fett verbrennens“ beim Training. Es wird im chemischen Sinne wirklich verbrannt.
Wie sieht also die Reaktion mit Sauerstoff (O2) aus? Man muss es sich so vorstellen: die Sauerstoff-Atom-Paare kommen an das Ethan und trennen sich und verbinden sich mit Teilen davon. Jeweils zwei Wasserstoff werden mit einem Sauerstoff zu Wasser gebunden (H2O). Und jedes der Kohlenstoff verbindet sich jeweils mit zwei Wasserstoff-Atomen zu Kohlenstoffdioxid („di-oxid“ für zwei-Sauerstoff).
Anstatt nur ein Elektron abzugeben bzw. zu nehmen, können Atome auch mehrere Elektronen für chemische Bindung mit einem anderen Atom nutzen. So gibt das Kohlenstoff-Atom je zwei Elektronen an den Sauerstoff ab, der damit (8 Elektronen gesamt, 6 in der äußeren Schale) seine freien Valenzen gefüllt hat. Diese Bindung ist stärker als die Ein-Elektron-Bindung innerhalb des Ethans.
Wenn es nicht genügend Sauerstoff gibt, passieren die Dinge etwas anders. Die Reaktion zu Wasser ist total leicht. Die passiert trotzdem. Aber der Kohlenstoff kettet sich an sich selbst und wir zu Kohle oder wie wir das von einer flackernden Kerze kennen, Ruß. Sollte trotzdem etwas Sauerstoff übrig sein, verbindet der sich zu dem giftigen Kohlenstoffmonoxid, da das ein Sauerstoff-Atom weniger braucht und wir ja gesagt haben, dass so wenig davon da sind.
Bindungen mit wenig Elektronen benötigen wenig Energie, um sie zu „erschaffen“, sind aber nicht sehr stark. Da Wasserstoff nur 1 Elektron besitzt, was Bindungen eingehen kann, sind Wasserstoff-Verbindungen immer Reaktionsstark, da Wasserstoff immer nur mit diesem einen Elektron an andere Atome gebunden werden kann.
Das Kohlenstoffmonoxid ist trotz Dreifachbindung instabil, da nicht alle Elektronen verwendet werden können. Sauerstoff hat sechs Elektronen in der äußeren Schale, Kohlenstoff vier. In der Bindung sind deswegen „unbeschäftigte“ Elektronen vorhanden, die gerne Reaktionen eingehen würden. Kohlenstoffmonoxid ensteht oft bei Kraftfahrzeugen, kann wegen seiner Instabilität jedoch mit Hilfe eines Katalysators und mehr Sauerstoffs einfach zu Kohlenstoffdioxid gemacht werden.
Jetzt haben wir auch gesehen, warum verbrannte Dinge schwarz werden. Wenn alle anderen Reaktionen, das gesamte oxidieren, so weit abgelaufen sind, bleibt fast immer noch etwas Kohlenstoff übrig.
Wir haben viel Sauerstoff in der Atmosphäre und der reagiert gern und oxidiert gern unsere Sachen. So geht Eisen (Fe) gerne Verbindung mit Sauerstoff ein. Eisenoxid ist auch unter dem Namen „Rost“ bekannt. Kupfer geht diese Verbindung auch gern ein und wird, im Gegensatz zum Rot des Eisens, gern grün.
Verbrennen ist oxidieren von Kohlenstoff. Warum das mit Wasser nicht geht, ist also eigentlich schon klar: Es besitzt keinen Kohlenstoff. Aber auch sonst, wenn wir genauer hinschauen, geht das Wasser beim Erhitzen keine weitere chemische Verbindung mit Sauerstoff ein. Warum nicht? Wir haben es beim Ethan schon gesehen. Wasser ist, so sagt uns schon die Summenformel H2O, bereits „verbrannter“ Wasserstoff. Wasser kann also nicht weiter anbrennen, weil es schon längst verbrannt ist. Und so trägt Wasser seinen chemischen Namen Di-Hydro-Mono-Oxid. Zwei Wasserstoff mit einem Sauerstoff oxidiert.
Es ist keine reife Leistung, dass ich noch kein Wasser habe anbrennen lassen.